Trabajo
escrito sobre las propiedades físicas químicas micro biológicas y todo lo relacionada al “agua”
Aprendiz:
Jhon Alexander Sánchez Marín
Tecnólogo en agua y saneamiento nocturno
San José del Guaviare
Sena regional
Introducción:
Según lo que hemos visto atravesó de la historia y el correr del tiempo
nos hemos dado cuenta que el agua es una de las sustancias más abundante del
planeta y confiábamos que así lo seria,
y si así es pero no de la forma que lo esperábamos pensamos que esta sustancia estaría limpia o
potable por un largo tiempo pero nos equivocamos. Las acciones del ser humano
en su lucha por ser cada día mejor hizo que no se diera cuenta del daño que iba
dejando por su recorrido.
Pero dejando eso atrás pongamos nuestro objetivo a lo que nos concierne el agua y todo lo que podemos saber de ella así
que en este pequeño resumen encontraras algunos datos útiles que te ayudaran de
alguna manera en tu formación.
Buenos días compañeros en el día de hoy hablaremos acerca del agua y
todo lo que concierne en si como lo es las propiedades químicas, físicas y micro biológicas además de conocer el siclo del agua y algunos términos
desconocidos o fundamentales.
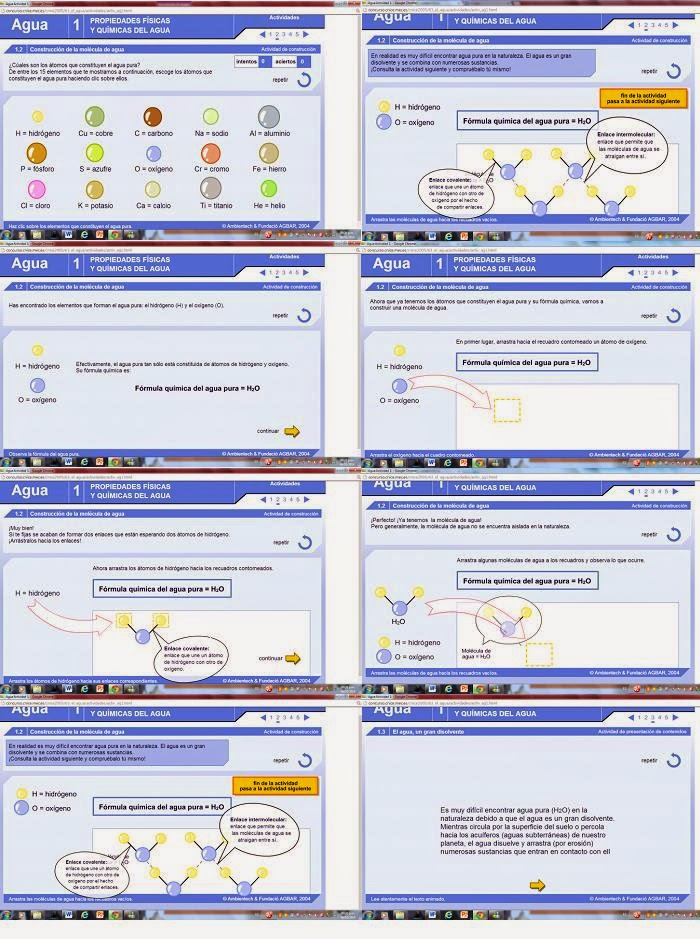
Primero es necesario conocer la
composición del agua
El agua es una sustancia compuesta por 2 átomos de hidrógeno y uno de
oxígeno y su fórmula es H2O
Además podemos
encontrarla en la naturaleza en varios estados como el sólido, líquido y gases
y sin olvidar su ciclo como se muestra en la figura.
A continuación se definirá en un cuadro algunos conceptos que tal vez
desconozcas del agua en sus tres estados de cómo pasa de uno al otro y si lo
conoces no importa volverás a repasar lo ya aprendido anteriormente.
CAMBIOS DE
ESTADO DEL AGUA EN LA NATURALEZA
EVAPORACIÓN
|
El calor del sol hace que el agua de ríos, mares, lagos, lagunas y
océanos se evapore, así como también el agua de la transpiración de plantas y
animales (Evapotranspiración). Recuerden que la evaporación es un proceso que
se da en la superficie del líquido a cualquier temperatura. La
ebullición es un proceso mucho más rápido y turbulento y se da en todo el
cuerpo de agua a una determinada temperatura que en el caso del agua pura y,
a presión normal, es de 100ºC.
|
CONDENSACIÓN
|
La formación de nubes es
un ejemplo de condensación. Cuando el aire, cargado de vapor de agua,
asciende, se enfría y se condensa en pequeñas gotitas de agua formando las
nubes.
Otro ejemplo de condensación es la formación del rocío. El vapor de agua que está en el aire se
condensa al ponerse en contacto con el suelo o la vegetación que han perdido
calor durante la noche.
|
SUBLIMACIÓN
|
Puede ocurrir que el vapor de agua pase directamente al estado sólido.
Esto pasa en noches muy frías, cuando el vapor de agua pasa directamente al
estado sólido sobre la superficie del suelo formando la escarcha. También en capas altas de
nuestra atmósfera (cuando el vapor de agua alcanza grandes alturas). De esta
manera el vapor de agua se sublima formando nubes llamadas cirrus que están formadas por
cristales de hielo.
|
CONGELACIÓN
|
El agua se transforma en hielo. Cada año esto ocurre al llegar el
invierno en las regiones polares. El agua del mar se solidifica. En algunas
regiones frías de la Tierra se congelan las superficies de los lagos. ¿Alguna
vez se preguntaron por qué el hielo no se hunde? El hielo es menos denso que
el agua líquida y flota. Es por eso que siempre está en la superficie del
líquido y no en el fondo de mares y lagos. La mayor densidad (peso) del agua
se da a los 4ºC, razón por la cual esa es la más baja temperatura que podemos
encontrar en el fondo. Es por eso que el fondo de los océanos no tiene
hielo.
|
FUSIÓN
|
El hielo se funde al recibir calor. Este fenómeno se da en la naturaleza
por ejemplo cuando llega el verano y se deshielan las cumbres de las
montañas. O cuando los copos de nieve atraviesan capas de aire más calientes
y se funden llegando a la superficie en forma de lluvia. O cuando al
salir del sol se derrite la escarcha.
|
VOLATILIZACIÓN
|
Este es el proceso mediante el cual el agua pasa directamente del
estado sólido al gaseoso. Se da en las zonas frías de nuestro planeta. Es
como la evaporación pero ocurre en la capa más superficial del hielo (sin
pasar por el estado líquido).
|
En este punto podemos decir ya que significa el agua así que pasemos a
sus propiedades químicas físicas y
microbiológicas. Aquí hago un punto donde quiero dejar claro que las
propiedades dadas a conocer en este documento son del agua en su estado natural
sin ningún otro componente o de otro tipo de agua como lo son las grises,
servidas o aguas contaminadas recordemos que cada tipo de agua tiene diferentes
composiciones tanto físicas como
químicas.
Propiedades físicas:
1) Estado físico: sólida, liquida y gaseosa
2) Color: incolora
3) Sabor: insípida
4) Olor: inodoro
5) Densidad: 1 g./c.c. a 4°C
6) Punto de congelación: 0°C
7) Punto de ebullición: 100°C
8) Presión critica: 217,5 atm.
9) Temperatura crítica: 374°C
2) Color: incolora
3) Sabor: insípida
4) Olor: inodoro
5) Densidad: 1 g./c.c. a 4°C
6) Punto de congelación: 0°C
7) Punto de ebullición: 100°C
8) Presión critica: 217,5 atm.
9) Temperatura crítica: 374°C
Propiedades Químicas del Agua
1) Reacciona con los óxidos ácidos
2) Reacciona con los óxidos básicos
3) Reacciona con los metales
4) Reacciona con los no metales
5) Se une en las sales formando hidratos
2) Reacciona con los óxidos básicos
3) Reacciona con los metales
4) Reacciona con los no metales
5) Se une en las sales formando hidratos
1) Los anhídridos u óxidos ácidos reaccionan
con el agua y forman ácidos oxácidos.
2) Los óxidos de los metales u óxidos básicos reaccionan con el agua para formar hidróxidos. Muchos óxidos no se disuelven en el agua, pero los óxidos de los metales activos se combinan con gran facilidad.
3) Algunos metales descomponen el agua en frío y otros lo hacían a temperatura elevada.
4) El agua reacciona con los no metales, sobre todo con los halógenos, por ej.: Haciendo pasar carbón al rojo sobre el agua se descompone y se forma una mezcla de monóxido de carbono e hidrógeno (gas de agua).
5) El agua forma combinaciones complejas con algunas sales, denominándose hidratos.
2) Los óxidos de los metales u óxidos básicos reaccionan con el agua para formar hidróxidos. Muchos óxidos no se disuelven en el agua, pero los óxidos de los metales activos se combinan con gran facilidad.
3) Algunos metales descomponen el agua en frío y otros lo hacían a temperatura elevada.
4) El agua reacciona con los no metales, sobre todo con los halógenos, por ej.: Haciendo pasar carbón al rojo sobre el agua se descompone y se forma una mezcla de monóxido de carbono e hidrógeno (gas de agua).
5) El agua forma combinaciones complejas con algunas sales, denominándose hidratos.
Características
Microbiológicas:
Los microorganismos más importantes que podemos
encontrar en las aguas son: bacterias, virus, hongos, protozoos y distintos
tipos de algas (por ej. Las azul verdosas). La contaminación de tipo
bacteriológico es debida fundamentalmente a los desechos humanos y animales, ya
que los agentes patógenos –bacterias y virus- se encuentran en las heces, orina
y sangre, y son de origen de muchas enfermedades y epidemias (fiebres
tifoideas, disentería, cólera, polio, hepatitis infecciosa,...). Desde el punto
de vista histórico, la prevención de las enfermedades originadas por las aguas
constituyó la razón fundamental del control de la contaminación.
En la red de control de aguas superficiales se
analizan los Coliformes totales y Escherichia coli que es un indicador de contaminación
fecal. En la red de control de aguas de baño se realizan controles de
Escherichia coli y Enterococos intestinales.
Coliformes
totales:
Las bacterias del género coliformes se encuentran
principalmente en el intestino de los humanos y de los animales de sangre
caliente, es decir, homeotermos, pero también ampliamente distribuidas en
la naturaleza, especialmente en suelos, semillas y vegetales. Los coliformes se
introducen en gran número al medio ambiente por las heces de humanos y animales.
Por tal motivo suele deducirse que la mayoría de los coliformes que se
encuentran en el ambiente son de origen fecal. Sin embargo, existen muchos
coliformes de vida libre.
Tradicionalmente se los ha considerado como
indicadores de contaminación fecal en el control de calidad del agua destinada
al consumo humano en razón de que, en los medios acuáticos, los coliformes son
más resistentes que las bacterias patógenas intestinales y porque su origen es
principalmente fecal. Por tanto, su ausencia indica que el agua es
bacteriológicamente segura. Asimismo, su número en el agua es proporcional al
grado de contaminación fecal; mientras más coliformes se aislan del agua, mayor
es la gravedad de la descarga de heces.
No todos los coliformes son de origen fecal, por lo
que se hizo necesario desarrollar pruebas para diferenciarlos a efectos de
emplearlos como indicadores de contaminación. Se distinguen, por lo tanto, los
coliformes totales -que comprende la totalidad del grupo- y los coliformes
fecales -aquellos de origen intestinal-. Desde el punto de vista de la salud
pública esta diferenciación es importante puesto que permite asegurar con alto
grado de certeza que la contaminación que presenta el agua es de origen fecal.
Escherichia
coli:
Escherichia coli (E. coli) es quizás el organismo
procarionte más estudiado por el ser humano, se trata de una bacteria que se
encuentra generalmente en los intestinos animales y por ende en las aguas
negras. Es la bacteria más conocida del grupo de los coniformes, y E. coli, en
su hábitat natural, vive en los intestinos de la mayor parte de mamíferos
sanos. Es el principal organismo anaerobio facultativo del sistema digestivo.
Como indicador de la calidad del agua se considera
como indicador de contaminación fecal reciente.
Enterococos
intestinales:
Los entero-cocos intestinales incluyen las especies
del género Streptococcus y son un subgrupo del grupo más amplio de los
estreptococos fecales. Estas bacterias son grampositivas y relativamente
tolerantes al cloruro sódico y al pH alcalino.
El grupo de los enterococos intestinales puede
utilizarse como índice de contaminación fecal, ya que la mayoría de las
especies no proliferan en medios acuáticos. La concentración de enterococos
intestinales en las heces humanas es, generalmente, alrededor de un orden de
magnitud menor que la de E. coli. Este grupo presenta importantes ventajas:
tienden a sobrevivir durante más tiempo que E. coli (o que los coliformes
termotolerantes) en medios acuáticos, y son más resistentes a la desecación y a
la cloración. Los enterococos intestinales se han utilizado en el análisis del
agua natural como índice de la presencia de agentes patógenos fecales que
sobreviven durante más tiempo que E. coli.
Los enterococos intestinales se excretan
habitualmente en las heces humanas y de otros animales de sangre caliente.
Algunas especies de este grupo también se han detectado en suelos, en ausencia
de contaminación fecal. Hay concentraciones altas de enterococos intestinales
en las aguas residuales y en los medios acuáticos contaminados por aguas
residuales o por residuos humanos o animales.
Este repaso se hace con el fin de conocer a
profundidad el agua aunque sabemos que
este tema es bastante extenso solo es un repaso por lo básico así que por
últimos aquí hay uno términos desconocidos con su significado para que tengan
más conocimiento y puedan adquirir un conocimiento completo.
DUREZA DEL AGUA:
En química,
el agua calcárea o agua dura —por contraposición
al agua
blanda— es aquella que contiene un alto nivel de
minerales, en particular sales de
magnesio y calcio.1 A
veces se da como límite
La
dureza del agua se expresa normalmente como cantidad equivalente de carbonato
de calcio (aunque propiamente esta sal no se
encuentre en el agua) y se calcula, genéricamente, a partir de la suma de
las concentraciones de calcio y magnesio existentes
(miligramos)
por cada litro de
agua; que puede expresarse en concentración de CaCO3.
Es decir:
Dureza
(mg/l de CaCO3) = 2,50 [Ca++] + 4,16 [Mg++]. Dónde:
[Mg++]: Concentración de ion Mg++ expresado
en mg/l.
Riesgos del agua dura:
El agua descrita como "dura" significa
que es alta en minerales disueltos, específicamente calcio y magnesio. El agua dura no es un riesgo para la salud, pero
una molestia a causa de su tendencia a causar la acumulación de minerales en la
tubería de agua y sistemas de calefacción.
LA ANTRACITA:
Es
el carbón mineral más metamorfoseado y
el que presenta mayor contenido en carbono. Es
de color negro a gris acero con un lustre
brillante.
Estando
seca y sin contar cenizas la masa de la antracita posee 86% o más de carbono y
14% o menos de volátiles. Comparado
con otros carbones es poco contaminante y de alto valor calorífico (~35 megajoules por
kilogramo). Cabe destacar que no difiere mucho en cuanto a calorías con la
mayoría de los carbones
bituminosos (hullas). Comparado con estos últimos
carbones la antracita no mancha al ser manipulada. También destaca entre
sobre otros carbones por su bajo contenido de humedad.
La antracita es
difícil de prender, se quema lento y requiere mucho oxígeno para su combustión generando
en el proceso muy pocas flamas (y
de color azul pálido) pero emitiendo mucho calor.
Antiguamente se
usaba en plantas de centrales
termoeléctricas así como en hogares para calentar. Su uso en
hogares posee las ventajas de producir poco polvo al manipularse, quemarse
lento y producir poco humo. Debido a su alto costo y relativa escasez ha sido
desplazado por gas
natural y electricidad en
cuanto su uso para calefacciones. Hoy en día se usa principalmente para
producir coque
El coque es un combustible sólido formado por
la destilación de carbón bituminoso calentado a temperaturas de 500 a 1100 °C sin contacto con el aire. El proceso de destilación implica que
el carbón se limpia de alquitrán, gases y agua. Este combustible o residuo se compone
en 90 a 95% de carbono. Nitrógeno, oxígeno, azufre e hidrógeno están presentes en cantidades menores. Es poroso y de color negro a gris
metálico. El coque se utiliza en
grandes cantidades en altos hornos para la elaboración de hierro
aprovechando la siguiente reacción química.
EL GAS DE CLORO:
A
temperatura normal, el Cloro es un gas, tiene un color verde-amarillento.
Es
más pesado que el aire, así que normalmente se concentra a nivel del piso. Esto
significa que los sótanos, áreas de almacenamiento subterráneas, los pozos para
elevadores y otras áreas en su trabajo pueden convertirse en lugares peligrosos
en caso de un escape o derrame accidental.
Tiene
un olor penetrante y huele a blanqueador. Y su relación del agua o que tiene
que ver el cloro sirve para :
Esto es cloro en
su forma pura. Es almacenado y transportado en cilindros, como gas-licuado. La
reacción química con el agua es:
Cl2(g) + H2O
<--> HOCl + H+ + Cl-
A diferencia del
sodio o hipoclorito de calcio, el cloro gaseoso disminuye el pH del agua.
Ventajas -
desinfectante muy efectivo, reduce el pH del agua de manera que acidificación
adicional no es necesario, disolución uniforme y rápida en el agua.
Ahora pasemos a lo
que concierne las leyes que protegen esta líquido del mal uso del ser humano.
Decreto 1594,1984: Vertimientos (uso del agua y
recurso líquido)
Decreto 901,1997: Vertimiento.
Ley 373,1997: Por la cual se establece el programa para el uso eficiente y ahorro del agua.
Ley 9,1979: Medidas sanitarias acerca del uso del agua
Decreto 2340,1984: Uso del agua y residuos líquidos
Decreto 0901,1997: Utilización directa o indirecta del agua como receptor de los vertimientos puntuales
Decreto 1074,1997: Estandarización ambiental en materia de vertimientos
.
Decreto 2105,1983: Potabilización y suministro de agua
Ley 0079,1986: Consumo de Agua.
CÓDIGO SANITARIO LEY 9 DE 1979
Del control sanitario de los usos del agua.
ARTICULO 3o. Para el control sanitario de los usos del agua se tendrán en cuenta las siguientes opciones, sin que su enunciación indique orden de prioridad.
a) Consumo humano;
b) Doméstico;
c) Preservación de la flora y fauna;
d) Agrícola y pecuario;
e) Recreativo;
f) Industrial;
g) Transporte.
Decreto 901,1997: Vertimiento.
Ley 373,1997: Por la cual se establece el programa para el uso eficiente y ahorro del agua.
Ley 9,1979: Medidas sanitarias acerca del uso del agua
Decreto 2340,1984: Uso del agua y residuos líquidos
Decreto 0901,1997: Utilización directa o indirecta del agua como receptor de los vertimientos puntuales
Decreto 1074,1997: Estandarización ambiental en materia de vertimientos
.
Decreto 2105,1983: Potabilización y suministro de agua
Ley 0079,1986: Consumo de Agua.
CÓDIGO SANITARIO LEY 9 DE 1979
Del control sanitario de los usos del agua.
ARTICULO 3o. Para el control sanitario de los usos del agua se tendrán en cuenta las siguientes opciones, sin que su enunciación indique orden de prioridad.
a) Consumo humano;
b) Doméstico;
c) Preservación de la flora y fauna;
d) Agrícola y pecuario;
e) Recreativo;
f) Industrial;
g) Transporte.
ARTICULO 6o. En la determinación de las
características deseables y admisibles de las aguas deberá tenerse en cuenta por
lo menos, uno de los siguientes criterios:
a) La preservación de sus características naturales;
b) La conservación de ciertos límites acordes con las necesidades del consumo humano y con el grado de desarrollo previsto en su área de influencia.
c) El mejoramiento de sus características hasta alcanzar las calidades para consumo humano y las metas propuestas para un conveniente desarrollo en el área de influencia.
a) La preservación de sus características naturales;
b) La conservación de ciertos límites acordes con las necesidades del consumo humano y con el grado de desarrollo previsto en su área de influencia.
c) El mejoramiento de sus características hasta alcanzar las calidades para consumo humano y las metas propuestas para un conveniente desarrollo en el área de influencia.
LEY 99 DE 1993
Por la cual se crea el MINISTERIO DEL MEDIO AMBIENTE,
se reordena el Sector Público encargado de la gestión y conservación del medio ambiente y
los recursos naturales renovables,
se organiza el Sistema Nacional Ambiental
Ley 373 DE 1997
Por la cual se establece el programa para el uso eficiente y ahorro del agua.
Por la cual se establece el programa para el uso eficiente y ahorro del agua.
Todo plan ambiental regional y municipal debe
incorporar obligatoriamente un programa para el uso eficiente y ahorro del
agua. Se entiende por programa para el uso eficiente y ahorro de agua el
conjunto de proyectos y acciones que deben elaborar y adoptar las entidades
encargadas de la prestación de los servicios de acueducto, alcantarillado,
riego y drenaje, producción hidroeléctrica y demás usuarios del recurso
hídrico.
Las Corporaciones Autónomas Regionales y demás autoridades ambientales encargadas del manejo, protección y control del recurso hídrico en su respectiva jurisdicción, aprobarán la implantación y ejecución de dichos programas en coordinación con otras corporaciones autónomas que compartan las fuentes que abastecen los diferentes usos.
Las Corporaciones Autónomas Regionales y demás autoridades ambientales encargadas del manejo, protección y control del recurso hídrico en su respectiva jurisdicción, aprobarán la implantación y ejecución de dichos programas en coordinación con otras corporaciones autónomas que compartan las fuentes que abastecen los diferentes usos.
DECRETO 2105
de 1983
Reglamenta parcialmente la Ley 09 de a 1979 sobre potabilización y suministro de agua para consumo humano
DECRETO 2811 DE 1974
LIBRO PRIMERO DEL AMBIENTE
PARTE I.
DEFINICIÓN Y NORMAS GENERALES DE POLÍTICA AMBIENTAL
ARTICULO 8o. Se consideran factores que deterioran el ambiente, entre otros:
a). La contaminación del aire, de las aguas, del suelo y de los demás recursos naturales renovables.
Se entiende por contaminación la alteración del ambiente con sustancias o formas de energía puestas en él, por actividad humana o de la naturaleza, en cantidades, concentraciones o niveles capaces de interferir el bienestar y la salud de las personas, atentar contra la flora y la fauna, degradar la calidad del ambiente de los recursos de la nación o de los particulares.
Se entiende por contaminante cualquier elemento, combinación de elementos, o forma de energía que actual o potencialmente pueda producir alteración ambiental de las precedentemente descritas. La contaminación puede ser física, química o biológica;
Reglamenta parcialmente la Ley 09 de a 1979 sobre potabilización y suministro de agua para consumo humano
DECRETO 2811 DE 1974
LIBRO PRIMERO DEL AMBIENTE
PARTE I.
DEFINICIÓN Y NORMAS GENERALES DE POLÍTICA AMBIENTAL
ARTICULO 8o. Se consideran factores que deterioran el ambiente, entre otros:
a). La contaminación del aire, de las aguas, del suelo y de los demás recursos naturales renovables.
Se entiende por contaminación la alteración del ambiente con sustancias o formas de energía puestas en él, por actividad humana o de la naturaleza, en cantidades, concentraciones o niveles capaces de interferir el bienestar y la salud de las personas, atentar contra la flora y la fauna, degradar la calidad del ambiente de los recursos de la nación o de los particulares.
Se entiende por contaminante cualquier elemento, combinación de elementos, o forma de energía que actual o potencialmente pueda producir alteración ambiental de las precedentemente descritas. La contaminación puede ser física, química o biológica;
b). La degradación, la erosión y el revenimiento de suelos y tierras.
C. Las alteraciones nocivas de la topografía.
d). Las alteraciones nocivas del flujo natural de las aguas;
e). La sedimentación en los cursos y depósitos de agua;
f). Los cambios nocivos el lecho de las aguas.
g). La extinción o disminución cuantitativa o cualitativa de especies animales o
vegetales o de recursos genéticos;
h). La introducción y propagación de enfermedades y de plagas;
i). La introducción, utilización y transporte de especies animales o vegetales
dañinas o de productos de sustancias peligrosas;
j). La alteración perjudicial o antiestética de paisajes naturales;
k). La disminución o extinción de fuentes naturales de energía primaria;
l). La acumulación o disposición inadecuada de residuos, basuras, desechos y
desperdicios;
m). El ruido nocivo;
n). El uso inadecuado de sustancias peligrosas;
o). La entronización, es decir, el crecimiento excesivo y anormal de la flora en
lagos y lagunas.
p). La concentración de población humana urbana o rural en condiciones
habitacionales que atenten contra el bienestar y la salud.
Aunque estas leyes mencionadas aquí no es ni la décima
parte es solo un adelanto de lo concierne al estudio del agua.
Bueno espero que les haya ayudado a conocer más acerca del agua y sus estados y composición alguna recomendación escríbanme o que otros temas quieren ver relacionado con el agua y los tendré en cuenta
Bueno espero que les haya ayudado a conocer más acerca del agua y sus estados y composición alguna recomendación escríbanme o que otros temas quieren ver relacionado con el agua y los tendré en cuenta
después de realizar esta actividad realizaremos otra de conocimiento así que los que quieran interactuar dejare un enlace donde lo pueden hacer. y probar los conocimientos adquiridos
ademas como otro método de repaso o de conocer mas les dejo estos enlaces
espero haberlos ayudado hasta la próxima.